- Accueil
- L'association LMC France
- La LMC
- Qu'est-ce que la LMC ?
- Historique de la LMC
- Comprendre la maladie
- La LMC en vidéos et en images
- Diagnostic et évolution
- Traitement et suivi
- Paroles d'experts
- Les recommandations pour l'arrêt de traitement dans la LMC
- Les recommandations pour le traitement de la LMC
- La LMC et les génériques
- Les recommandations pour le suivi biologique de la LMC
- Les difficultés liées à l'observance par le Docteur Hélène Hoarau
- Interprétation du caryotype, biologie moléculaire par le Docteur Marie-Joëlle Mozziconacci
- Traitements et arrêt de traitement de la LMC
- La gestion des effets secondaires par le Professeur Mauricette Michallet
- Le parcours d'un patient LMC par le Docteur Gabriel Etienne
- Diagnostic et annonce de la LMC par le Docteur Cony-Makhoul
- Les progrès thérapeutiques actuels: quelles perspectives par le Professeur Michallet
- La prise en charge des patients par le Docteur Aude Charbonnier
- Les essais cliniques par le Docteur Delphine Réa
- Accompagner les progrès thérapeutiques par le Docteur Franck Nicolini
- L’éducation thérapeutique en hématologie par le Professeur Philippe Rousselot
- Lexique sur la leucémie
- Au service du patient
- Évènements
- La recherche
- LMC France soutient la recherche
- LMC France soutient la recherche en 2013
- Colloques et congrés
- LMC France à CML Horizons 2017
- LMC France à CML Horizons 2016
- LMC France à CML Horizons 2015
- LMC France à CML Horizons 2014
- LMC France à CML Horizons 2013
- LMC France à CML Horizons 2012
- LMC France à New Horizons 2011
- Congrès EHA 2014
- Congrès ASH 2014
- Congrès ASH 2013
- Congrès ASH 2012
- Congrès ASH 2011 : la LMC du point de vue des patients
- Congrès ASH 2011 : formation sur la LMC
- Journée Patients Fi LMC
- Journée Nationale Innovation Santé
- Agenda
- Contact
- Photos
- Vidéos
Congrès ASH 2014
American Society of Hematology 2014
ASH 2014, San Francisco : optimisation du traitement de la LMC

Le congrès de l'ASH est l'événement annuel le plus important pour les chercheurs dans le domaine de l'hématologie.
Ce congrès, rassemblant plus de 30 000 professionnels de santé, est une plate-forme de pointe où les chercheurs présentent les tout derniers
résultats de leur travail et où ils en débattent. C'est aussi pour eux une occasion de se rencontrer et de discuter d'efforts conjoints.
Certains parlent aussi de privation collective de sommeil : les journées de travail commencent habituellement avant le lever du soleil pour se
terminer le soir par des réceptions animées à l'aide de présentations PowerPoint.
À la différence du congrès de l'EHA, le programme scientifique du congrès de l'ASH ne propose rien en matière de défense des patients, ni même
un accès gratuit aux défenseurs des patients. C'est pourquoi les défenseurs des patients ne constituent que 0,1 % du public présent environ.
Environ 35 défenseurs des patients, originaires de tous les continents et représentant toutes les maladies, étaient présents lors de ce 56e
congrès de l'ASH à San Francisco. Deux d'entre eux, Giora Sharf et Jan Geissler relatent certaines des dernières nouvelles concernant la LMC,
qui ont fait l'objet de présentations et de posters.
État des lieux de la LMC à l'ASH 2014
Si l'on se retourne sur les 15 dernières années, depuis l'introduction de l'imatinib dans les premiers essais cliniques, on peut constater que le traitement de la LMC a connu une véritable
révolution. Grâce à la recherche, la LMC, autrefois un cancer mortel, est devenue une maladie chronique qui, chez la plupart des patients, lorsqu'elle est diagnostiquée rapidement, reste
durablement stable. En 2008 exactement, alors que le congrès de l'ASH se tenait déjà à San Francisco, nous étions tous enthousiasmés par les premiers résultats obtenus avec les médicaments de
deuxième génération, représentant bien souvent, outre la greffe de moelle osseuse, le dernier espoir des patients résistants ou intolérants à l'imatinib. Nous étions alors inquiets à l'idée qu'un
nombre croissant de patients développent une résistance et n'aient plus de possibilité d traitement.
Aujourd'hui, la survie des patients souffrant d'une LMC à la phase chronique est similaire à celle de la population générale, toutes tranches confondues : la qualité du traitement de la LMC a été
démontrée par une présentation du projet EUTOS au congrès de l'ASH. Ce projet a agrégé les données d'essais cliniques de l'imatinib menés dans six groupes d'étude européens différents de la LMC.
L'objectif était d'établir la probabilité de décès dû à une LMC et de la comparer à la probabilité de décès d'une autre cause quelconque. Comparativement aux taux de mortalité de la population
générale, en l'espace de 8 ans, seulement 4 % des patients sont décédés de LMC, 7 % étant décédés de causes n'ayant aucun lien avec la leucémie. Chaque décès dû à une LMC est un décès de trop,
mais ces décès sont heureusement devenus relativement rares.

Aujourd'hui, nous disposons de cinq traitements cibles efficaces et largement tolérables pour la LMC. Les données à 7 ans obtenues pour le dasatinib et les données à 6 ans obtenues pour le
nilotinib, présentées lors du congrès 2014 de l'ASH, démontrent des taux croissants de bonne réponse parmi les patients. Parallèlement, nous apprenons à mieux gérer les comorbidités et les effets
secondaires. Ainsi, la recherche sur la LMC concerne largement l'optimisation du traitement de la LMC, l'importance, sur le plan pronostique, d'atteindre une valeur BCR-ABL de 10 % pendant les 3
premiers mois de traitement, les conditions d'une rémission sans traitement, l'amélioration de la qualité de vie, la gestion des effets secondaires et des comorbidités, l'augmentation de
l'adhésion et enfin la guérison de ce cancer chronique.
C'est pourquoi, dans le domaine de la LMC, aucune nouvelle stupéfiante n'a été présentée en 2014 lors du congrès de l'ASH, contrairement aux années précédentes. En un sens, il y a bien des bonnes
nouvelles, compte tenu de là où nous en sommes déjà arrivés en termes de traitement de la LMC. La prochaine nouvelle stupéfiante, nous l'espérons, sera l'annonce d'un traitement médical curatif
pour tous les patients atteints de LMC. Malheureusement, un tel traitement semble encore hors d'atteinte.
ASH - Rapport 1 : arrêt du traitement de la LMC pour une rémission sans traitement
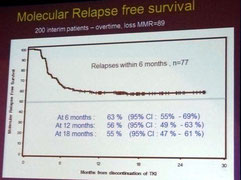
La rémission sans traitement, ou arrêt du traitement en cas de rémission moléculaire profonde stable à long terme, a probablement été LE sujet le plus traité lors du congrès de l'ASH cette
année.
L'étude EURO-SKI (European Stop Tyrosine Kinase Inhibitor), l'étude d'arrêt du traitement la plus vaste en cours, vient de finir de recruter 700 patients. Une analyse intermédiaire des 200
premiers patient issus de 8 pays d'Europe, qui ont été suivis pendant au moins 12 mois, a donc été présentée. Cette étude a pour but de définir des marqueurs pronostiques afin d'augmenter le taux
de patients en réponse moléculaire profonde durable après l'arrêt du traitement par TKI, d'évaluer les procédures de surveillance moléculaire et d'évaluer la qualité de vie.
À la différence d'études antérieures, comme les études françaises STop IMatinib (STIM) ou les essais de Novartis ENEST Stop, cette étude présente des critères d'éligibilité légèrement plus
souples exigeant seulement une MR4 (BCR-ABL < 0,01 %) pendant plus de 1 an sous traitement par TKI de 3 ans minimum, et une réinstauration du traitement lorsque la réponse moléculaire majeure
(MMR, BCR-ABL > 0,1 %) est perdue. À titre de comparaison : Les premières études françaises STIM exigeaient une réponse moléculaire plus profonde (MR4.5, BCR-ABL < 0,0032 %) et une
ré-instauration immédiate du traitement lorsque la réponse MR4.5 était perdue. Pour les 200 patients de l'étude EURO-SKI, la durée médiane du traitement a été de 8 ans (plage: 3-13 ans) et la
durée de réponse MR4 avant arrêt des TKI était de 5 ans (plage : 1-12 ans).
Suite à l'arrêt du traitement, 111 des 200 patients (56 %) sont restés sans traitement après l'arrêt des TKI et 89 ont rechuté. Comme dans l'étude STIM, la plupart des récidives sont intervenues
très rapidement, au cours des 6 premiers mois. Parmi les 89 patients qui ont présenté une récidive, 76 avaient de nouveau atteint une réponse MMR et 70 une réponse MR4 à la date du rapport. Aucun
patient n'a progressé vers une phase avancée de la maladie. En termes de facteurs pronostiques de récidive, la durée du traitement antérieur par TKI et le fait d'avoir obtenu une réponse MR4
durant plus de 5 ans avant l'arrêt du traitement ont semblé avoir un impact positif, tandis que la profondeur de la réponse moléculaire (MR4 vs MR4.5 vs MR5) avant l'arrêt du traitement n'a pas
eu d'influence sur le risque de récidive. 31 des 200 patients ont eu des effets secondaires liés à l'arrêt du traitement, principalement des douleurs musculaires, articulaires ou osseuses, mais
aussi des symptômes de type transpiration, problèmes cutanés, épisodes dépressifs, fatigue ou perte de poids. Aucun de ces effets secondaires n'a été très sévère (grade 4). Des débats sont
toujours en cours sur la façon de gérer et de prévenir ces « symptômes de sevrage thérapeutique ». Les économies estimées pour les systèmes de santé, dans les 8 pays de l'étude EURO-SKI, sont de
7 millions d'euros d'après les estimations.
L'étude étudiera aussi les facteurs pronostiques, la qualité de vie et d'autres facteurs susceptibles d'avoir une influence sur la faisabilité de l'arrêt du traitement. Les résultats les plus
intéressants sont donc à suivre. Il est à noter que le rapport présenté lors du congrès de l'ASH cette année ne concerne qu'une analyse intermédiaire des 200 premiers patients, sur 700 patients
au total.

L'étude STOP-2G-TKI, menée par le groupe d'étude français de la LMC, a recruté 52 patients. Les critères d'inclusion de cette étude étaient un peu plus stricts, nécessitant un
traitement antérieur par TKI de 2e génération (dasatinib, nilotinib, bosutinib) avec une rémission MR4.5 pendant au moins 2 ans. 52 patients ayant suivi un traitement par TKI d'une durée médiane
de 6,5 ans et en rémission MR4.5 d'une durée médiane de 2,3 ans ont été évalués dans ce rapport présenté à l'ASH. Ces patients ont été suivis pendant 12 à 60 mois. Comme l'étude EURO-SKI, cette
étude a utilisé la perte de MMR (BCR-ABL 0,1 %) comme un critère de ré-instauration du traitement. 24 des 52 patients (46 %) ont perdu la MMR et ont dû reprendre le traitement.
Toutefois, un point a soulevé des débats à l'issue de la présentation : Alors que la plupart des récidives sont intervenues très rapidement (médiane : 3,7 mois), une récidive est intervenue 24
mois après l'arrêt du traitement et une autre 37 mois après l'arrêt du traitement. Le patient avec récidive au mois 37 avait reçu en traitement de première ligne un TKI de 2e génération et était
resté en rémission moléculaire très profonde jusqu'à peu de temps avant la récidive. En conclusion, il semble évident que les patients doivent être régulièrement surveillés, même plusieurs années
après l'arrêt du traitement. Cependant, la bonne nouvelle est que ce patient, après avoir repris le traitement, a de nouveau bénéficié d'une réponse moléculaire profonde. Globalement, aucun des
patients n'a vu sa LMC progresser vers une phase avancée. Chez tous les patients, une MMR a été rétablie en 1-6 mois et une MR4 en 1 à 21 mois.
De toute évidence, les facteurs pronostiques autour de l'arrêt du traitement restent obscurs : L'étude EURO-SKI avait révélé que la durée du traitement antérieur par TKI et la durée de la MR4
avant l'arrêt du traitement semblent augmenter la chance de rémission sans traitement. L'étude française STOP-2G-TKI n'a pas montré d'association avec l'âge, le sexe, le risque selon l'échelle de
Sokal lors du diagnostic, le traitement antérieur par interféron, la durée du traitement par TKI, la durée de la réponse MR4.5 et le type de TKI antérieur, tandis qu'une réponse sous-optimale ou
une résistance à l'imatinib réduit la probabilité que l'arrêt du traitement réussisse sous traitement par dasatinib/nilotinib. La troisième étude d'arrêt présentée lors de ce congrès de l'ASH,
l'étude imatinib Suspension and Validation Study (ISVA), a démontré des taux de récidive similaires à ceux des études EURO-SKI et STOP-2G-TKI, mais a montré qu'un âge < 45 ans ou la détection
de BCR-ABL dans un test plus sensible de « PCR numérique » augmentaient le risque de récidive. Enfin, l'étude KIDS (Korean Imatinib Discontinuation Study) a eu pour conclusion que la durée de la
réponse moléculaire profonde et le traitement par l'imatinib étaient les facteurs de prédiction les plus importants pour la réussite de l'arrêt du traitement. Il n'y a pas encore de terrain
d'entente actuellement en termes de facteurs pronostiques.
Pour mieux déterminer si certaines caractéristiques spécifiques du système immunitaire d'un patient donné ont une influence sur le risque de récidive après arrêt du traitement, une sous-étude
EURO-SKI cherche à déterminer comment le système immunitaire maintient une LMC résiduelle sous contrôle à l'aide des lymphocytes T et des cellules Natural Killer (cellules NK), et si les TKI ont
une influence sur le système immunitaire. Les résultats semblent montrer que les patients qui récidivent présentent une proportion et un nombre absolu de cellules NK plus faibles au moment de
l'arrêt du traitement par TKI. Cette présentation a soulevé la question de savoir si la mesure de ces paramètres pourrait aider à prédire la récidive et incite à étudier plus en détail les
mécanismes biologiques et les facteurs spécifiques de patient.
Résumé et réflexions
Pendant la session de formation, le Docteur Michael Maurao, spécialiste de la LMC, a conclu qu'« il semble possible d'obtenir une rémission sans traitement » et que l'« inquiétude liée à un
risque à long terme associé à une tentative de rémission sans traitement n'a pas augmenté », à condition de rester dans le cadre d'une surveillance très stricte.
Ces déclarations se basent sur les données de quatre études d'arrêt différentes présentées lors du congrès de l'ASH de cette année. Une surveillance étroite, dans le cadre d'une étude clinique,
un diagnostic par PCR très sensible, mené dans les meilleurs laboratoires et doté d'une sensibilité suffisamment fiable pour la mesure de la MR4.5 et une ré-instauration immédiate du traitement
lorsque la PCR dépasse la réponse moléculaire majeure (MMR) semblent fournir un cadre extrêmement sûr pour l'arrêt du traitement. Selon l'étude et les critères de ré-instauration du traitement,
la proportion de patients restant en rémission moléculaire profonde va de 40 à 60 %. Les études ENESTnd (nilotinib en traitement de première ligne) et DASISION (dasatinib en traitement de
première ligne) semblent montrer que plus de la moitié des patients traités par TKI de 2e génération obtiennent une MR4.5 en environ deux ans et que seulement la moitié d'entre eux récidiverait
en cas d'arrêt du traitement. En conséquence, environ un patient atteint de LMC sur quatre pourrait arrêter le traitement de la LMC après plusieurs années d'adhésion au traitement et maintenir
une rémission stable sans traitement.
Cependant, la récidive tardive observée au mois 37 dans l'étude STOP-2G-TKI semble indiquer que, même après plusieurs années de rémission sans traitement, une surveillance moléculaire régulière
et une ré-instauration rapide du traitement en cas de perte de la MMR pourraient être essentielles. Aucun des patients ayant récidivé dans ces quatre études n'a connu une progression de la LMC,
mais cela n'a clairement été possible que dans le cadre d'études cliniques étroitement contrôlées, avec une surveillance par PCR très fréquente et sensible et avec une ré-instauration immédiate
du traitement par TKI en cas de perte de la MMR. Aujourd'hui, rien ne permet de prédire quel patient pourra arrêter le traitement sans récidiver. La connaissance des mécanismes qui font que
certains patients récidivent alors qu'ils présentent une maladie minimale résiduelle tandis que d'autres ne récidivent pas n'en est qu'à ses premiers balbutiements. Des études telles que l'étude
EURO-SKI et ses sous-études nous aideront à mieux comprendre ces phénomènes. Dans l'attente des résultats et de modes de diagnostic standardisés permettant une détection fiable de la MR4.5 et de
la récidive moléculaire précoce, les experts s'en tiennent à leur recommandation de ne pas arrêter le traitement en dehors des essais cliniques, une recommandation qu'ils ont réaffirmée lors de
ce congrès de l'ASH.
ASH - Rapport 2 : nouvelles données sur le ponatinib - extrêmement puissant mais surdosé ?
Le ponatinib, premier inhibiteur de tyrosine kinase de 3e génération et potentiellement l'un des médicaments les plus puissants contre la LMC actuellement sur le marché, a connu des hauts et des
bas depuis deux ans.
La communauté des patients suit le développement du ponatinib depuis la présentation des premières données d'une étude de phase I de AP24534, aujourd'hui nommé ponatinib/Iclusig, lors du congrès
de 2009 de l'ASH. Compte tenu qu'il s'agit du seul médicament efficace contre T315I et certaines autres mutations de multirésistance, et puisqu'il semble agir très efficacement chez de nombreux
patients même après l'échec de l'imatinib, du dasatinib et du nilotinib, ce médicament a beaucoup attiré l'attention. Du fait d'un trajet règlementaire difficile lié à de nouvelles inquiétudes
quant à son profil d'effet secondaire, la communauté de la LCM était curieuse de découvrir les nouvelles données sur le ponatinib présentées lors du congrès de 2014 de l'ASH. Étaient
particulièrement intéressants la mise à jour concernant les effets secondaires et les facteurs de risques, de même que la question de savoir si les participants à l'essai ayant dû réduire leur
dose de ponatinib répondaient toujours bien au médicament tout en le tolérant mieux.
Contexte
En décembre 2012, le ponatinib (Iclusig), le seul médicament actif sur la LMC avec mutation de multi-résistance T315I, était autorisé aux États-Unis. Le 31 octobre 2013, la Food and Drug
Administration (FDA) suggérait à ARIAD, le fabricant du ponatinib, de suspendre de son propre chef la commercialisation du ponatinib et tous les essais cliniques en cours. Cette demande était
consécutive à l'observation, dans le cadre de la surveillance continue de la sécurité d'emploi dans les essais cliniques en cours, d'une augmentation constante du nombre d'événements de formation
de caillots sanguins potentiellement mortels et de sténose sévère des vaisseaux sanguins. En janvier 2014, après une évaluation plus poussée des données, la commercialisation du ponatinib a
repris aux États-Unis, avec une autorisation plus restreinte, une mise à jour des informations de sécurité d'emploi destinées aux médecins, et l'exigence qu'ARIAD réalise de nouveaux essais
portant sur des doses plus faibles, la réponse au traitement et la toxicité du ponatinib.
En parallèle, le comité pour l'évaluation des risques en pharmacovigilance (PRAC) de l'Agence européenne du médicament (EMA) a réalisé une étude des données disponibles et a conclu que le risque
d'obstruction de vaisseaux sanguins avec le ponatinib est probablement lié à la dose. Cependant, dans le même temps, les données n'étaient pas suffisantes pour recommander l'utilisation de doses
plus faibles, susceptibles de ne pas être aussi efficaces chez tous les patients ni pendant un traitement à long terme. À la différence de la FDA, peut-être également parce que l'autorisation
accordée par l'EMA ne permettait l'utilisation du ponatinib que comme traitement de troisième ligne après échec ou intolérance au dasatinib ou au nilotinib, l'EMA a continué à autoriser le
ponatinib en Europe à la même dose (45 mg/jour), mais a aussi demandé des essais cliniques supplémentaires.
Nouvelles données sur le ponatinib présentées lors de l'ASH 2014
Six présentations et posters portaient sur le ponatinib lors du congrès de l'ASH cette année.
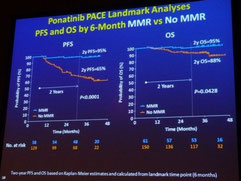
La première présentation, faite par le Dr Martin Müller, de Mannheim, était une mise à jour concernant l'étude de phase II PACE, analysant l'obtention de réponses de la LMC au médicament au début du traitement. Il est à noter que les participants à cette étude n'avaient pas répondu au dasatinib ou au nilotinib ou qu'ils présentaient une mutation T315I avant leur inclusion à l'étude. 60 % des patients avaient reçu au moins trois autres traitements par TKI avant de recevoir le ponatinib. 80 % des patients étaient résistants au nilotinib ou au dasatinib et seulement 15 % étaient intolérants aux deux médicaments. La durée médiane écoulée depuis le diagnostic était de 7 ans et la durée médiane de suivi des patients pendant l'étude était de 38 mois. Après 12 mois de traitement par le ponatinib, 56 % des patients avaient obtenu une réponse cytogénétique complète et 39 % une réponse moléculaire majeure (BCR-ABL < 0,1 %). La survie globale à deux ans a été de 90 % des patients avec une valeur BCR-ABL < 1 % dans les 3 mois suivant le début du traitement par le ponatinib et de 84 % des patients avec BCR-ABL toujours supérieur à 1 % après 3 mois. L'obtention d'une réponse moléculaire majeure (MMR) au début du traitement par le ponatinib, même pour les patients précédemment lourdement traités, a semblé améliorer les résultats. Ceci signifie que, même après l'échec d'autres TKI de 2e génération, une proportion significative de patients obtient de bonnes réponses avec le ponatinib. Une surveillance précoce de la réponse sous traitement par le ponatinib pourrait aider à décider s'il faut poursuivre le traitement ou si une greffe de moelle osseuse pourrait être une solution préférable pour le patient concerné. Les bénéfices et les risques du ponatinib, en tenant compte aussi des comorbidités, devront être évalués pour chaque patient individuel.

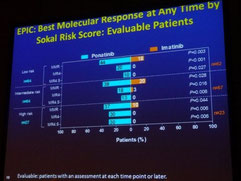
Une seconde présentation, faite par le Docteur Jeff Lipton, a porté sur l'essai de phase III EPIC, qui étudie le ponatinib en traitement de première ligne après
diagnostic d'une LMC, et le compare à l'imatinib. Bien que l'étude ait été suspendue en octobre 2013 en raison des inquiétudes liées à la sécurité d'emploi mentionnées plus haut, les données de
sécurité d'emploi et d'efficacité recueillies avant l'arrêt de l'étude, date à laquelle les patients avaient reçu le ponatinib pendant une durée médiane de 5 mois, ont été présentées. 36 % des
patients sous ponatinib ont dû réduire la dose (initialement 45 mg/jour) en raison d'effets secondaires et 57 % ont dû arrêter le traitement. Cependant, 94 % des patients sous ponatinib, contre
68 % des patients sous imatinib, ont atteint une valeur BCR-ABL < 10 % à 3 mois et 15 % des patients sous ponatinib, contre aucun des patients sous imatinib, ont atteint une réponse MR4.5 dans
ce cours laps de temps. Toutefois, l'incidence d'événements indésirables graves a été clairement plus importante avec le ponatinib. Les événements les plus critiques ont été les problèmes de
coagulation sanguine, intervenus chez 7 % des patients sous ponatinib et moins de 1 % des patients sous imatinib. Cependant, parmi les 12 patients ayant présenté ces événements vasculaires, 11
avaient au moins un facteur de risque cardiovasculaire ou un antécédent médical en rapport.
Peut-on dire alors que la dose initiale de 45 mg/jour utilisée dans toutes les études était trop élevée ? Des doses initiales fixes de 45 mg/jour de ponatinib ont été utilisées dans toutes les
études récentes de cette molécule ; cependant, la possibilité d'interrompre le traitement et de réduire la dose, dans ces essais, couplée à des évaluations multiples des réponses moléculaires des
patients, a permis une exploration de la relation dose réponse. Une analyse, présentée sur le poster 4546, a montré que le nombre moyen de jours nécessaires pour une division des niveaux initiaux
de BCR-ABL par 10 était de 47,5 jours pour le ponatinib, contre le double pour les patients sous imatinib. Chez les patients nouvellement diagnostiqués, même des doses de ponatinib de seulement
15 mg par jour ont entraîné des diminutions plus rapides des niveaux de BCR-ABL qu'une dose quotidienne de 400 mg d'imatinib.
Pour ce qui concerne l'association des doses et des effets secondaires, une analyse de 671 patients sous ponatinib dans différentes études, présentée sur le poster 4546, a démontré que le niveau
de dose de ponatinib est associé à de nombreux effets secondaires, dont une coagulation sanguine et une sténose des vaisseaux sanguins.
Les données justifient d'étudier des approches visant à réduire le niveau de dose moyen, par exemple en commençant le traitement par des doses plus faibles et/ou en réduisant la dose lorsqu'une
réponse est obtenue, afin de réduire la toxicité tout en conservant l'efficacité élevée du traitement. Des essais de détermination de la dose du ponatinib sont actuellement en cours
Réflexions diverses
Une grande partie des données présentées lors du congrès 2014 de l'ASH reflètent l'importance du ponatinib en termes d'efficacité, même dans le contexte d'un traitement de troisième ligne.
Cependant, ces données soulignent aussi les inquiétudes liées à la toxicité, qui semble nettement plus marquée à la dose actuellement autorisée de 45 mg de ponatinib par jour qu'avec tous les
autres TKI à leur dose standard. Pour les patients qui présentent une résistance ou une intolérance à l'imatinib, au dasatinib et au nilotinib, et pour les patients porteurs de la mutation T315I,
le ponatinib est un traitement important : il peut même être leur seule option.
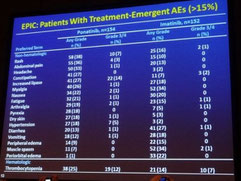
Toutefois, il semble que les essais qui ont permis l'autorisation du ponatinib aient visé trop haut en termes de posologie, en visant à l'excès l'efficacité maximale contre la LMC et en ne
consacrant pas assez de temps à une étude suffisante de la toxicité. C'est ainsi que le chemin a été particulièrement houleux pour les patients, les autorités et le fabricant, avec des hauts et
aussi des bas, lorsqu'il s'est avéré qu'une proportion importante des patients souffraient d'effets secondaires sévères. Les mécanismes responsables de ces effets secondaires sont encore mal
compris (ce qui est vrai non seulement pour le ponatinib, mais aussi pour d'autres problèmes cardiovasculaires plus rares mais cependant réels affectant certains patients sous nilotinib,
dasatinib et imatinib). Pour autant, de nombreux abstracts présentés lors du congrès AHS2014 démontrent que la communauté mène de nombreuses recherches sur ce sujet ainsi que sur tous les
médicaments, ce qui, faut-il le répéter, se fait au bénéfice des patients qui participent aux essais comparativement aux patients recevant les nouveaux médicaments en dehors des essais, sachant
que de nombreuses études et centres d'étude ont mené une surveillance cardiovasculaire des patients à risque dès que les inquiétudes ont été soulevées.
Lors du congrès de l'ASH, il est devenu évident que les médecins surveilleraient plus étroitement les facteurs de risque cardiovasculaires de chaque patient, par exemple hypertension, diabète et
antécédent d'événement cardiovasculaire. Les données concernant le ponatinib présentées lors du congrès 2014 de l'ASH reflètent très bien ces discussions sur le rapport bénéfice/risque. Elles
fournissent une excellente base pour les essais de détermination de la dose qui pourront étudier des schémas posologiques dynamiques pour un traitement restant efficace tout en présentant moins
d'effets secondaires.
Par exemple, l'essai à venir SPIRIT 3, au RU, coordonné par le Docteur Stephen O'Brien, permettra d'évaluer l'utilisation sélective d'une dose optimisée de ponatinib chez des patients qui ne
répondent pas de façon optimale au traitement de première ligne et utilisera aussi le score QRISK2 pour évaluer le risque cardiovasculaire des patients souffrant de LMC. L'accent sera mis sur
l'équilibre entre l'efficacité et le risque pour chaque patient individuel.
Des plans d'essai innovants (comme celui de l'étude SPIRIT3) et les patients décidant de participer aux essais cliniques aideront sans aucun doute la communauté à bien mieux comprendre ces
problèmes à l'avenir.
Traduction effectuée par :
Source :
CML Advocates network
Jan Geissler et Giora Sharf
Congrès de la Société Américaine d’Hématologie - ASH 2014
